24 Окт 12 КОРРОЗИЯ СТАЛИ В БЕТОНЕ. ПЕРИОД РАЗВИТИЯ
Параметры, определяющие развитие коррозии. Вид коррозии определяется действующей средой, а скорость - степенью поляризации анодного или катодного процессов, которая влияет на уровень и разность их потенциалов, или электрическим сопротивлением цементной матрицы [7.42].
Так, питтинговая коррозия обычно контролируется поляризациен анодного процесса и сопротивлением этектролита. Степень катодной по ляризации не играет существенной роли за исключением случаев непроницаемости бетона для кислорода, как, например, в подводных конструкциях.
Общая коррозия, возникающая вследствие карбонизации бетона, контролируется преимущественно сопротивлением, хотя не исключено влияние анодной поляризации, особенно в присутствии хлоридов в бетоне, резко увеличивающих его электропроводность. Катодной поляризации нельзя ожидать, если первопричиной депассивации является карбонизация, пока доступ кислорода к поверхности арматуры не станет почему-либо ограничивающим фактором.
|
E. v |
|
|
|
-0,5 |
|
-I |
![]()
|
ПЕРИОД КОРРОЗИИ |
Низкопотенциальная коррозия возможна только в условиях, когда доступ кислорода к катодным участкам резко ограничен и коррозионный процесс будет иод катодным контролем.
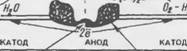
Питтинговия коррозия. Процесс питтинговой коррозии (рис. 7.14) для своего поддержания требует присутствии хлорида, кислорода и влаги, но для открыто экспонированных конструкций, не имеющих поверхностной защиты, возможно, что поступление кислорода к катодным поверхностям арматуры не будет ограничивать скорости коррозии. Однако отмечено, что соотношение между активирующим (хлорид) и пассивирующим (гидроксил) ионами может быть критическим. Соответственно относительное преобладание хлорида или гидроксила на активных участках поверхности может контролировать развитие коррозии или их репассивацию.
Поскольку некарбониэированный бетон является богатым источником гидроксил-ионов, поступление хлорида к корродирующим участ кам поверхности может быть решающим фактором, от которого зависит продолжение процесса коррозии. Количество свободных хлоридов, поступающих к анодным участкам, будет определяться: общей концентрацией хлорида в бетоне; общим содержанием цемента в бетоне; соотношением связанного и свободного хлоридов; скоростью диффузии хлоридов в бетоне; стабильностью хлоридсодержащих продуктов коррозии. На поддержание защитной или ренассивирующей концентрации гидроксила влияют:
Общее содержание цемента в бетоне; степень гидратации цемента;
Количество гидроксила, образующегося при гидратации, за вычетом поглощаемого при снижении рН в питтинге.
Потенциал питтинга разблагораживается (становится более отрицательным) с возрастанием концентрации хлорида, что означает ускорение коррозии. Отрицательный наклон этой зависимости показывает, что коррозия контролируется анодным процессом и катодная поверхность имеет относительно постоянное значение в ускорении коррозии при возрастании концентрации хлорида.
Общая коррозия. Обшая коррозия стали в бетоне с большим содержанием хлорида исследована совсем мало.
В карбонизированном бетоне скорость коррозии зависит главным образом от относительной влажности воздуха в пределах 50... 100%. В зависимости от проницаемости бетона влияние кислорода может ощущаться лишь при влажности, близкой к 100%, когда вследствие капиллярной конденсации влаги микропоры плотного бетона становятся практически непроницаемыми для газов. В таких условиях резко тормозится процесс карбонизации, т. е. при прочих равных условиях длительно сохраняется состояние пассивности стали. Аналогично этому маловероятна контролирующая роль анодной поляризации, так как снижение рН при карбонизации ниже 9 при всех обстоятельствах исключает пассивацию. Таким образом, основными влияющими на коррозию факторами, становятся факторы, связанные с сопротивлением электролита в карбонизированной пористой структуре. В отсутствие хлоридов это, видимо, имеет прямую связь с содержанием влаги.
Присутствие хлоридов снижает сопротивление, но об ускорении коррозии можно говорить только, если их содержание ниже критического, так как в противном случае уже в некарбонизированном бетоне будет наблюдаться питтинговая коррозия.
|
А 0г нг0 |
|
ОН' + он |
Рис. 7.14. Схема рецир - кулицпн хлор-ионои при ИИПИНГОВОЙ коррозии
ЦЕМТНТН КАМЕНЬ
ПАССИВНА)!
|
|
|
Stz |
|
ТВЕРДЫЕ ПРОДУКТЫ КОРРОЗИИ |
|
FeClfiiHiO |
ППЕНКл АРМАТУРА
Таким образом, параметры, контролирующие коррозию в карбони зированном бетоне, будут связаны с уровнем равновесной влажности или структурой циклического увлажнения и высыхания, а также с возможным повышением проводимости из-за отсутствия в бетоне хлоридов на уровне, недостаточном для питтинга.
Низкопотенциальная активность. Экспериментальные данные подтверждают существование такой формы коррозии при катодном контроле, обусловленном резким ограничением доступа кислорода. Скорость этого вида коррозии, вероятно, связана со скоростью коррозии в более изученных условиях. Так, при высокой концентрации хлоридов в насыщенном влагой бетоне, по-видимому, низкопотенциальная коррозия идет быстрее, чем в отсутствие хлоридов. Этот вид коррозии будет развиваться даже в таких условиях, когда кислорода недостаточно для поддержания тока утечки через пассивную пленку. Поэтому решающим параметром низкопотенциальной активной коррозии является концентрация кислорода на катодной поверхности.
Коррозия под действием солей, содержащихся в бетоне и окружающей среде. Из разд. 7.1 следует, что наиболее благоприятно для долговечности конструкций пассивное состояние стали, когда при любом влаж - ностном состоянии цементного бетона арматура практически не подпер» гас ієн Koppojiin. Пассивное состояние арматуры сохраняете»:, пока пе произойдет снижение рН норовой влаги бетона ниже некоторого предела (примерно 11,5) , либо содержание в ней ионов-активаторов, в частности, хлорид-ионов, не превысит некоторое критическое значение (0,1...0,4% по массе цемента).
И то, и другое условие может наступить уже при изготовлении конструкции. Снижение рН может быть результатом либо интенсивного связывания гидроксида кальция активной составляющей заполнителя (например, мелкими фракциями керамзита), либо использования бесцементных или малоцеменшых вяжущих (например, автоклавного твердения). Хлориды могут присутствовать в составе вяжущего, заполнителей и воды затворения, а также добавок-ускорителей твердения и противомороз - ных. Если их количество в жидкой фазе будет выше крнтичежого, то сталь не будет пассивироваться при твердении бетона. То же произойдет, если значение рН не достигнет указанного гюедела.
В обоих этих случаях процесс коррозии арматуры начинается уже при изготовлении конструкции, т. е. практически без инкубационного периода (см. разд. 7.1), и скорость его развития будет зависеть в основном от влажности бетона в процессе эксплуатации конструкции: в постоянно
сухих условиях, либо при постоянном водонасыщении бетона (конструкции под водой) коррозия практически не будет развиваться При промежуточном или переменном значении влажности бетона коррозия будет развиваться со скоростью, величина которой будет зависеть от многих факторов (температурно-влажностный режим, толщина и проницаемость защитного слоя бетона, содержание хлоридов в нем и т. д.).
В случае, если обеспечено первоначальное защитное действие бетона, т. е. сталь в нем не активируется при изготовлении конструкции, то она может потерять пассивность только в результате изменения в составе поровой влаги под действием среды, на что потребуется, очевидно, тем большее время (инкубационный период), чем ниже агрессивность среды, чем толще защитный слой бетона и больше его реакционная емкость, чем меньше его проницаемость.
Таким образом, должны быть самостоятельно рассмотрены: вяжущие и бетоны, не обеспечивающие первоначального защитного действия из-за пониженного значения рН; то же, содержащие хлориды;
Данные о критическом содержании хлоридов, вызывающем депассива - цию стали в бетоне;
Методы расчета длительности инкубационного периода в случае нейтрализации бетона кислыми газами;
То же, в случае диффузии хлоридов из окружающей среды; период развития коррозии с учетам ее опасности для разных видов арматуры и конструкций.
Поскольку период развития коррозии арматуры — наиболее трудно прогнозируемая величина, имеет смысл сразу рассмотреть относящиеся к нему данные, чтобы не возлагать больших надежд на возможность существенного продления прогнозных сроков службы конструкций, арматура которых по тем или иным причинам корродирует
Факторы, определяющие скорости коррозии стали в бетоне. Пассивное состояние стали в бетоне обеспечивается, как уже упоминалось, достаточным уровнем рН (> 11,5 при отсутствии хлоридов) поровой влаги, а при наличии хлоридов — отношением их активности к активности гидроксильных ионов (> 0,6) , а также зависит от наложенного потенциала (7.35).
Сталь в таком состоянии можно считать защищенной от коррозии, однако для поддержания защитной оксидной пленки расходуется небольшой ток, а следовательно, необходим кислород. Пока нет адекватной модели, отражающей зависимость скорости реакции от таких факторов, как качество защитного слоя и потенциал металла.
Использование с целью изучения этого процесса потенциостатической методики требует деаэрации электролита, что не так просто для бетона и может вызвать химические изменения в зоне контакта стали и бетона.
Плотность тока пассивного состояния, определенного по этой методике, примерно на 3 порядка ниже, чем в щелочном электролите того же состава, что и поровая жидкость. По-видимому, это происходит в результате высокого диффузионного сопротивления бетона и слоя портлан - дита у поверхности стали (7.56) перемещению ионов железа иэ зоны контакта оксида с бетоном. Возможно, что, если плотность тока пассивации будет не слишком мала, то потенциал при ограниченном доступе кислорода окажется ниже критического для хлоридной коррозии.
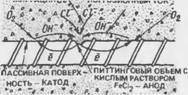
Состояние питтинговой коррозии. Питтинг обычно развивается в бетоне с хорошей проводимостью, некарбонизированном при умеренном содержании хлоридов или локализованном их распределении, например при хлоридном загрязнении заполнителя. Пассивность нарушается локально в местах высокой концентрации хлорида или слабой пассивной пленки. Эти места становятся локальными анодами, а катодами — соседние участки пассивной поверхности (рис. 7.15).
Образовавшиеся питтинги имеют преимущество в своем развитии перед "расползанием" или образованием новых. На аноде (питтинге) электролит подкисляется, на катоде — подщелачивается, усиливается действие концентрационной гальванопары. Резкому понижению рН в питтинге способствует высокая плотность тока и гидролиз, связанный с окислением Fe2+ до Fe3+ по краям бугорка ржавчины над пигтингом. Миграция ионов хлора к аноду, а также общее падение среднего коррозионного потенциала в результате поляризации катода мешают образованию поблизости новых питтингов, по крайней мере, до появления новых участков с существенно большей концентрацией хлорида.
Потенциал может начать смещаться в сторону замедления процесса в результате уменьшения плотности анодного тока из-за снижения разности потеїщиалов, увеличения площади анода в связи с нейтрализацией бетона вокруг анода кислой жидкостью, мигрирующей из питтинга. Возможна даже ренассивация питтинга благодаря встречной диффузии катионов и анионов.
Важной особенностью питтинговой коррозии является растворимость продуктов коррозии в среде с низким рН вблизи анода, в связи с чем может развиться значительное поражение арматуры без повреждения (растрескивания) защитного слоя бетона.
Развитие питтинговой коррозии могут облегчать следующие качества бетона:
Низкое электрическое сопротивление, способствующее действию мак - рогальванических пар и облегчающее миграцию ионов;
Высокое содержание щелочей и гидроксида кальция, препятствующее расширению и способствующее углублению питтинга;
Проницаемость для кислорода, определяющая суммарные коррозионные потери.
Однако при больших значениях соотношения катодных и анодных площадей интенсивный питтинг возможен даже при ограниченном доступе кислорода. Поступление кислорода облегчается, если бетон частично высыхает, но ускоряющему действию этою фактора противостоит высокое сопротивление и уменьшение влажности близ анода.
|
«UUrDAIIUarT" 1/ПпЛЛИ. лим, ./Ї тт/' ;
|
Состояние общей коррозии. Общая коррозия наблюдается как результат карбонизации или наличия в бетоне большого количества хлоридов, когда образуется множество близко расположенных питтингов. Поверх-
Рис. 7.15. Схема развития питтинговой коррозии арматуры в бетоне с хлоридами
ность превращается в смешанный электрод, где невозможно различить анодные и катодные участки. Разница в рН выравнивается и анодное растворение происходит в нейтральной или щелочнои влаге, где есть доступ кислорода. Продукты коррозии в этом случае образуют плотную ржавчину, вызывающую растрескивание бетона па ранней стадии процесса.
Протекание процесса коррозии, вызванной карбонизацией, отличается от хлоридной. Карбонизированный бетон обычно имеет значительную проницаемость и невысокую влажность. Поэтому коррозия арматуры в нем контролируется относительно высоким сопротивлением и недостатком влаги более, чем диффузией кислорода. Скорость коррозии определяется длительностью увлажнений (например, осадками), достигающих поверхности арматуры, поэтому, иерояпю, скорость коррозии возрастает постепенно с увеличением влажности. Туути [7.63] наблюдал с помощью коррозионной электрохимической ячейки резкое замедление коррозии при таком повышении влажности карбонизированного бетона, когда заполнение водой капилляров начинает ограничивать диффузию кислорода.
Наоборот, при хлоридной коррозии, наблюдающейся чаще всего при действии морской воды или солей антиобледенителей и в некоторых производствах, когда в бетоне достаточно воды и мало его электрическое сопротивление, скорость коррозии обычно контролируется диффузией кислорода.
Состояние активной, низкопотенциальной коррозии. Тот факт, что де - пассивация стали может происходить в условиях крайне ограниченного доступа кислорода, означает, что плотность тока катодного восстановления кислорода может быть меньше плотности тока пассивации. Это соответствует чрезвычайно малой скорости коррозии (порядка 0,1 мкм/ /год).
Активное состояние может быть также результатом действия периодической катодной защиты в среде с низким содержанием кислорода, поскольку при этом не только восстанавливается кислород у стальной поверхности, но и возрастает рН, а с ним и растворимость ферроат-ионов.
В низкопотенциальном состоянии возможна реакция водородной деполяризации (выделение водорода) катода, по с очень малой плотностью тока. Дальнейшее понижение потенциала при избыточной катодной защите сопровождается ростом потребляемого тока и выделением водорода.
Пока почти нет данных о влиянии вида цемента или состава бетона на развитие активного состояния. Вероятно, важно значение рН норовой влаги, но необходимы специальные исследования.
Эти соображения, которые вытекают из теоретического анализа контролирующих факторов процесса коррозии арматуры в бетоне и форм ее развития, не касаются особенностей коррозии под напряжением высокопрочной арматуры, которые будут рассмотрены далее. Будет показано также, что наибольшую опасность для арматуры железобетонных конструкций представляет коррозия, вызываемая хлоридами, особенно, если это высокопрочная арматура.
Особенности коррозии стали в различных агрессивных средах. Как уже указывалось выше, ионный состав электролита существенно влияет на положение границ между областями на диаграмме потенциал — рН. Влияние состава и концентрации солей па коррозию стали в жидких средах достаточно хорошо изучено и проявляется через воздействие на формирование или разрушение защитных пленок на поверхности металла и изменение электропроводности растворов (7.26,7.28). Хлористые, сернокислые и азотнокислые соли щелочных металлов образуют с железом хорошо растворимые продукты. Наиболее активно разрушают защитные пленки хлорид-ионы. Аммонийные соли имеют повышенную коррозионную активность в связи со способностью нона NH4 образовы Ишь с!;е-+ комплексные ионы.
Углекислые и фосфорнокислые соли образуют нерастворимые пленки солей железа на катодных участках, а соли некоторых окисляющих кислот, например хроматы и нитриты, — защитные пленки оксидного характера, что связано со способностью их анионов легко восстанавливаться
(ионы SO2 или СЮ-1 на железе восстанавливаются с трудом и не 4 4
Пассивируют его). Образующиеся защитные пленки устойчивы, как пра вило, при повышенных значениях рН. Поэтому кислые соли, понижающие рН раствора, обычно ускоряют коррозию, а основные — замедляют.
Ускорение коррозии с повышением концентрации солей в разбавленных электролитах И. Л. Розенфельд [7.21] связывает с увеличением концентрации анионов, образующих растворимые продукты коррозии Г. Улиг [7.28] — с повышением электропроводности.
В практике бетонных работ, например для ускорения твердения бетона, применяют добавку хлористого кальция, хлористого натрия, хлорного железа, соляной кислоты. В последнее время при низких температурах используют добавки поташа, нитрита натрия, нитрита кальция, нитри - та-иитрата кальция [7.22].
Коррозия в щелочных растворах в присутствии хлоридов. Пассив ность стали в щелочном электролите может быть нарушена хлорид-иона ми, которые вытесняют кислород из адсорбционных или фазовых слоев, тормозящих растворение железа. Механизм депассивации до конца не ясен, как и механизм пассивации. Однако имеется много экспериментальных данных, позволяющих выяснить критическую концентрацию хлорид-ионов, менее которой их присутствие не вызывает депассивации стали в щелочной среде. Естественно, что эта критическая концентрация зависит от величины pll электролита и содержания кислорода. Это под тверждаетен данными [7.51] о критической концентрации хлоридов ионов:
Раствор NaOH Са(ОН)2 Са(ОН)2
TOC \o "1-3" \h \z рН 13,2 12,5 11,6
Критическая концентрация
Хлорид-ионов, мг/л:
С кислородом 8900 710 72
Без кислорода — — 890
Данные о коррозии малоуглеродистой стали в щелочных растворах NaCI показывают (табл. 7.1), что при рН = 12,4 критическое значение отношения активности хлорид-ионов и гидроксида равно 0,61.
По данным [7 62], критическая концентрация хлорид-ионов в водної, вытяжке из цемента в отсутствие кислорода более 10 г/л. В насыщенном растворе Са(ОН)2, содержащем 0,1 моль/л NaCI, сталь корродировала лишь в присутствии кислорода [7.52]. С повышением концентрации NaCI от 0,02 до 0,08 моль/л вероятность коррозии возрастает от 0 до 100%.
|
Таблица 7.1. Коррозионная активность NaCl в щелочных растворах
|
Наши электрохимические исследования показали, что пассивность стали в водной вытяжке из портландцемента нарушается при добавке 4...6 мг/л NaCl. По данным [7.37], в насыщенном растворе Са(ОН)2 это происходит при содержании 0,0035% СаС12 (0,022 г/л С1~).
На основании анализа имеющихся данных (табл. 7.2) можно полагать, что коррозия стали в насыщенном растворе Са(ОН)2 не развивается до тех пор, пока-концентрация хлорид-ионов не превосходит 0,03-0,05%.
Допустимое количество хлоридов в бетонной смеси и в бетоне обсуждается в течение многих лет. Имеются сторонники полного исключения возможности их присутствия в бетоне. Практики, особенно имеющие дело с бетонированием при холодной погоде, производители сборного железобетона, для которых важно сокращение времени выдерживания, а также вынужденные использовать хлоридсодержащие заполнители и добавки, выступают как сторонники минимальных ограничений.
Поскольку хлориды могут присутствовать естественным образом во всех составляющих бетонной смеси (заполнителях, цементе, добавках и воде), требование полного отсутствия хлоридов в любой смеси нереально.
Однако также известно, что, если в бетоне есть хлориды, опасность коррозии возрастает с увеличением их содержания. Когда содержание хлоридов превосходит некоторое критическое значение, недопустимая коррозия может произойти, если этому способствуют обстоятельства, в частности доступ кислорода и влаги, необходимых для поддержания коррозионного процесса.
Обоснование уровня содержания хлоридов в бетоне, ниже которого нет опасности коррозии, который пригоден при всех разновидностях составляющих бетонной смеси и всех условий службы конструкции и может быть измерен стандартным способом, является трудной задачей.
Необходимо различать три разных значения при аналитическом определении содержания хлоридов в составляющих, в бетонной смеси и бетоне: а — общие; б — растворимые в воде и в — растворимые в кислоте.
Общее ердержание хлорида в бетоне измеряется общим количеством хлора, определенного специальными аналитическими методами. Общеупотребителен метод определения хлоридов, растворимых в азотной кислоте. Часто его результат ошибочно принимают за общее содержание хлоридов. Водорастворимые хлориды извлекаются водой при определенных условиях. Получаемый результат зависит от методики, особенно от
|
Таблица 7.2. Количество хлоридов, вызывающее коррозию стали в щелочной среде
|
Степени измельчения пробы, времени экстракции, температуры, а также возраста и условий службы бетона. Важно также различать вид катиона (Na+, Са++ или др.). Удобнее всего выражать результаты анализов через содержание хлорид-ионов (С1~). Обычно содержание хлоридов относят к массе цемента.
Льюис [7.55] сообщает, что по результатам поляризационных испытаний стали как в насыщенном растворе гидроксида кальция, іак и в водной вытяжке из образцов гидратированного цемента коррозия наблюдалась, когда содержание хлорида составляло 0,33% растворимого в кислоте или 0,26% водорастворимого после 2-часовой экстракции.
Однако известно, что поровая влага бетона ца относительно высоко - щелочных цементах представляет собой раствор гидроксидов натрия и калия с рН, близким 14. Поскольку установлено, что пассивация стали зависит от отношения концентрации гидроксида и хлорида [7.46], допустимое количество хлорида в таком бетоне будет выше, чем то, которое вызывает питтинговую коррозию в насыщенном растворе гидроксида кальция.
По данным разных исследований, приведенных в [7.41], при проникании хлоридов в бетон извне критическая концентрация соответствовала 0,2% растворимых в кислоте хлоридов, от которых водорастворимые хлориды составляли 75-80%.
Однако при определении допустимого содержания хлоридов в материалах для бетона необходимо учитывать некоторые другие факторы. Прежде всего, водорастворимые хлориды составляют не постоянную часть кислоторастворимых. Их доля зависит от количества хлоридов в бетоне, его составляющих, методов определения [7.55]. Содержание хлоридов в затвердевшем бетоне зависит от состава цемента.
Обычно заполнители не содержат хлоридов, по могут быть исключения, например, нри использовании песка, добываемого с морского дна или пляжей, а также заполнителей карьеров, располагающихся в аридной зоне, с которыми в бетон может быть внесені) достаточное для депасси - вации стали количество хлоридов.
В обзоре [7.41] 0,06% кислоторасгворнмых хлоридов называется как верхний предел безопасного их содержании в общей массе заполнителей при необходимости выдержать известное ограничение их соде} ка - ния в бетоне величиной 0,4% по массе цемента [7.61]. Очевидно, должна быть разница в критическом содержании хлорида, когда он вводится в бетон с составляющими или проникает извне. В первом случае часть его химически связывается в основном с трехкальциевым алюминатом [7.61]. Хлорид, добавленный в смесь, распределяется достаточно равномерно без тенденции образования концентрационных пар.
При проникании же хлорида в бетон извне реально возникновение последних в результате неоднородности его концентрации в связи с разным поступлением к участкам поверхности, местных различий в проницаемости бетона и толщине защитного слоя.
Все эти факторы способствуют дифференциации бетона как среды на протяжении отдельного арматурного стержня по содержанию хлорида, влаги и кислорода. Кроме того, нужно иметь в виду электрический контакт между стержнями, расположенными в конструкции на разной глубине от поверхности, и, когда хлорид проннкает в бетон извне, то не достигает одновременно всех стержней. Следовательно, неизбежно образование коррозионных макропар с локальными анодными и большими катодными участками, что ускоряет коррозию.
Предполагается, что в морских условиях проникание хлоридов в бетон замедляется за счет его уплотнения гидроксидом магния [7.50].
По данным, приведенным в [7.41], заметная коррозия возникала в бетоне при добавлении 0,4—0,8% хлорида. По другим [7.40] критичесКим является уровень, отвечающий 0,3% добавленного хлорида или 0,4% проникающего извне.
Коррозия в нейтральных растворах
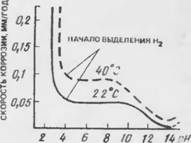
Строгое понятие нейтрального раствора связано со значением показателя концентрации водородных ионов pll = 7, который характерен для химически чистой воды с очень малой степенью диссоциации. Однако дистиллированная вода, практически свободная от солей, но находящаяся в равновесии с углекислотой воздуха, уже имеет рН = 6,7, т. е. является слабокислой. Кроме углекислоты, которая часто встречается в природных водах, гумусовые кислоты в болотных водах могут вызвать снижение рН до 4 единиц. Природные воды могут быть и слабощелочными, имея рН до 8,5, что связано с диссоциацией растворенных солей преобладающе основного характера, в частности в морской воде. Поэтому, с одной стороны, понятие нейтрального раствора для практических целей может быть расширено, тем более, что по многим данным скорость коррозии стали в воде в интервале рН 4...9 практически постоянна (рис. 7.16).
С другой стороны, растворы с рН = 7 могут быть весьма концентрированными, если содержат нейтральные соли, например, сульфат натрия, хлористый натрий, т. е. соли сильной кислоты и сильного основания. В этом случае на скорость коррозии будет влиять концентрация раствора. Однако ее влияние не однозначно. Как правило, в разбавленных раство-
Рис. 7.16. Скорость коррозии стали в воде при различных рН; добавки I1CI н кислой области и NaOll в щелочной при 22 и 40°С
Рах с ростом концентрации соли ускорение коррозии сменяется замедлением (рис. 7.17), что обычно связано с уменьшением растворимости кислорода (рис. 7.18).
Как уже говорилось, важен и вид соли, т. е. ее способность к активации или пассйвации стали. Так, наличие в растворе небольших концентраций хлоридов, роданидов или сульфатов, не выводя его из зоны нейтральности, может вызвать интенсивную коррозию стали, а наличие хро- матов или нитритов — состояние пассивности.
Нитраты щелочных металлов менее агрессивны, чем хлориды, а соли аммония существенно более агрессивны, фториды сильно агрессивны в небольших концентрациях, например фторид калия до 0,8п. Ускоряют коррозию ионы трехвалентного железа и меди.
Коррозионное состояние стали в бетоне зависит также от рН и ионк го состава жидкой фазы. Поэтому важно знать как критическое значение рН, ниже которого сталь не пассивируется, так и ионный состав ее, о і которого при прочих-равных условиях (проницаемость бетона, влажность) будет зависеть развитие коррозии арматуры в бетоне.
Кинетика коррозии стали в бетоне. Общая зависимость локального
Коррозионного тока J от начальных потенциалов катода /Г®, и анода Е ,
К /
Омического сопротивления R и поляризуемости катода Рк и анода Р, но П. Д.Томапмиу [7.26] выражается формулой
J=(Ј°K - Ј°a)/(CR +РК + РЛ). (7-3)
Несмотря на трудность использования этой формулы для расчетов коррозии, она позволяет анализировать процесс, определяя степень его ограничения каждой элементарной ступенью.
Использование методов измерения стационарных потенциалов и поляризации стали в бетоне извне наложенным током позволило оценить е электрохимическое поведение, а также установить зависимость ограничения коррозионного процесса от влажности бетона, которая влияет как на его проницаемость для кислорода, так и на омическое сопротивление. Часть образцов из бетона различной пористости на портландцемент, (табл. 7.3) со стержнями арматуры, расположенными на глубине от 15 до 45 мм от поверхности, после пропяишания хранили в течение 1 мес в воде, другую — в воздушно-сухих условиях.
|
|
Затем образцы погружали полностью или частично в 5%-й раствор NaCI. Так как четкой зависимости значения потенциалов от толщины защитного слоя установить не удалось, в табл. 7.4 приведены средние зн^-
0 0,250,50,75! 1,251,51.75 2
НОРМАЛЬНОСТЬ РАСТВОРОВ 1 1,5 2 2,5 д 5,5 4 4,5 5
НОРМАЛЬНОСТЬ СОЛЕВЫХ РАСТВОРОВ
Рис. 7.17. Влияние концентрации солей на коррозию стали при 35 °С за 2 сут
Рис. 7.18. Влияние концентрации солей иа растворимость кислорода в различных растворах при 25 °С
Чения потенциалов из 12 измерявшихся (на трех параллельных образцах при четырех толщинах защитного слоя).
Почти во всех случаях отмечается более низкое значение потенциала стали в бетоне большей пористости. При неполном погружении в насыщенных водой образцах потенциалы стали постепенно смещаться в положительную сторону, а в воздушно-сухих — в отрицательную.
Отмеченные особенности изменения потенциалов находят удовлетворительное объяснение. По Г. В.Акимову [7.1], в системе устанавливается значение потенциала
F° - F° - F0
F _ /г0 р К /1 _ сО. р 11К ^А
£общ ~ЬК ~ К ~~ +\4---------- , (7.4)
Где и — потенциалы соответственно катодного и анодного процесса; Р^, Рд, Р — поляризуемость соответственно катода, анода и всей системы.
Потенциалы на поверхности стали в бетоне равны [7.24]: катодной реакции (7.1), (7.24)
Е° =1,228 - 0,0591 рН Ю,1471 GP0J; (7.5)
Анодной реакции (7.2)
Е® = -0,440 + 0,0295 lg [Ье2+]. (7.6)
В уравнениях (7.5) и (7.6) в нашем случае могут иметь значение: рН от 12,5 до 9, парциальное давление кислорода PQ — нормальное (2,1 • 10~2 МПа или менее), а логарифм активности ионов двухвалентного железа в пределах от —11,73 до —4,73 (7.6) (в зависимости от рН).
Подсчитанные потенциалы приведены в табл.7.5.
С уменьшением парциального давления кислорода вследствие протекания катодного процесса и резкого замедления диффузии в насыщен ном водой бетоне понижается потенциал катодной реакции (см. табл 7.5), а с ним и потенциал всей системы, согласно уравнению (7 4). В бе тоне, насыщенном раствором NaCl, нарушается пассивность, т. е. умень шается анодная поляризуемость стали, в результате чего потенциал ока зывается более низким, чем в бетоне, насыщенном пресной водой
Таблица 7 3 Характеристика бетонов на портландцементе
|
ВЩ |
|
Расчетная пористость, 7. |
Расход цемента. Состав по массе Кг/м
|
0,5 0,6 0,7 |
|
360 300 257 |
|
13,68 14,40 14,92 |
1:2,23:2,92 1:2,82:3,53 1-3,43-4,17
|
Таблица 7.4. Потенциалы стальных электродов (но отношению к насыщенному каломельному электроду) в бетоне при погружении в 5%-й раствор NaCI
Полное погружение, 2 ч -246 -419 -586 -130 - 88 -112 Полное погружение, -308 437 -515 -.,97 -611 -690 100 сут |
Неполное погружение, 2 ч -214 -318 -534 -91 -91 -234
Неполное погружение, -120 -246 -325 -234 -440 -460 100 сут
|
Рн |
£^-в (7.5) при Pq^ , МПа |
В (7.6) |
|
|
2,1 ■ 10"2 [_ 2,1 ■ Ю-5 |
|
Таблица 7. 5. Значения/^. и Е^ |
|
9 12,5 |
|
+0,5966 +0,3898 |
|
+0,1456 -0,0512 |
|
-0,5795 -0,7860 |
Более высокое значение потенциала стали в образцах, частично погруженных в раствор, чем в полностью погруженных, связано с облегчением диффузии кислорода при неполном насыщении бетона. Повышение потенциала арматуры со снижением проницаемости беїопа снизано, по-видимому, с соответствующим уменьшением соотношении площади анодных и катодных участков, что непосредственно отражается на их поляризуемости.
Итак, при ускорении растворения стали на анодных участках понижается потенциал электрода в целом, равно как при замедлении диффузии кислорода к его катодным участкам. Поэтому судить о коррозионном состоянии стали в бетоне по значению потенциала можно лишь принимая во внимание вероятностный характер ограничения коррозионного процесса.
После 100 сут нахождения образцов в растворе NaCI образцы подвергли потенциостатической анодной поляризации для получения соответствующих кривых. Визуальная оценка извлеченных после этого иэ бетона стержней показала (табл. 7.6), что по степени возрастания язвенных поражений они располагаются в закономерной последовательности:
Полностью погруженные в насыщенном водой состоянии; полностью погруженные в сухом состояшш, частично погруженные в насыщенном водой состоянии; частично погруженные в сухом состоянии.
Сравнение но средневзвешенному баллу даег несколько иной порядок, но ни тот, ни другой не находятся в прямой зависимости от значения потенциалов.
Интересно сравнить плотность тока при потенциале +500 мВ по НВЭ, когда в обычном бетоне сталь должна еще бьмь пассивной, а в бетоне с хлоридами подвергаться активному растворению. Плотность тока при указанном потенциале находилась в пределах:
У образцов стали без следов коррозии 1,8...8 мкА/см2; у образцов с налетом ржавчины на большей части поверхности 8,5...234 мкА/см2;
У образцов с язвенными поражениями 14,6...500 мкА/см2.
|
Таблица 7.6. Состояние извлеченных из бе юна стальных стержней
|
Следовательно, коррозии стали в бетоне можно не опасаться, если плотность тока при наложенном потенциале +500 мВ не превышает 2,5 мкА/см2, а при 15 мкА/см2 коррозия может иметь язвенный характер.
В целом процесс коррозии стали в насыщенном водой бетоне и при относительной влажности воздуха 80-100% имеет анодцо-катодпое ограничение: при влажности воздуха 66—80% преобладает ограничение анодного процесса, а при 35—66% — анодно-омическое.
Поляризационные кривые позволяют выявить некоторые особенности электрохимического поведения стали в бе гоне.
В обычном бетоне без добавок, сохраняющем высокое значение рН, сталь находится в пассивном состоянии в широком диапазоне потенциалов: от +850 до —150 мВ (по НВЭ). В карбонизированном бетоне сталь активна, однако в воздушно-сухих условиях наблюдается значительное анодно-омическое ограничение коррозии вследствие высокого электрического сопротивления бетона.
Ila ocuoiiuiiiiu этих и других исследований значение рН жидкой фазы карбонизированною бсгоиа находится в области 8,5...9, чго существенно ниже значения, необходимого для пассивации стали.
Как показмваеі опыт, в суспензии CaCOj коррозионные шкн при потенциале +300 мВ на поверхности стали примерно в 1000 раз больше, чем в суспензии Са (011) 2 •
Эксперименты показали, что в карбонизированном бетоне коррозия стали протекает с незначительным анодным торможением. 1*.е скироеп зависит главным образом от электрического сопротивления бетона (табл. 7.7) , которое, в свою очередь, определяется его влажностным состоянием. Образцы из цементно-песчанош раствора состава 1:2 с В/Ц = 0,4 после двух месяцев хранения в атмосфере с влажностью 60—70% имели удельное сопротивление: некарбонизированные 86000, карбонизированные 400000 Ом см. У образцов с добавкой 1% СаС12 сопротш ление после карбонизации увеличилось с 23000 до 31 000 Ом - ем, т. е. значительно меньше, чем у образцов без добавки. Повышение сопротивления бетона снижает эффективность работы коррозионных пар на поверхности стали. Увлажнение конденсатом, осадками или технологическими жидкостями карбонизированного бетона снижает его сопротивление и нри отсутствии значительного анодного торможения приводит к интенсивной коррозии арматуры.
|
Бетон |
Таблица 7.7. Омическое сопротивление бетона
Сопротивление, Ом (среднее из трех образцов)
|
При относительной влажности воздуха, %
|
|
В воде |
|
I |
|
100 |
|
Без добавки: Обычный 142 334 Карбонизированный 2480 С добавкой СаСЬ: Обычный ~ 78 150 Карбонизированный 183 - |
В бетоне с добавкой СаС12 (сталь активна, причем заметное анодно- омическое ограничение процесса коррозии наблюдается лишь в очень сухом бетоне (при относительной влажности воздуха 35%). По ходу кривой катодной поляризации можно предположить возможность водородной деполяризации при потенциалах ниже — 550 мВ. Согласно расчету по диаграмме состояния воды (7.23), выделение газообразного водорода становится возможным при Е = -0,735 В, а атомарного (без образования пузырьков) — при значительно менее отрицательном потенциале. Это показывает, что остановить коррозию стали в таком бетоне путем изоляции от проникания кислорода практически очень трудно. При карбонизации бетона с СаС12 несколько увеличивается анодное ограничение коррозии в атмосферных условиях в связи с ростом омического сопротивления, облегчается водородная деполяризация (при рН = 9 потенциал выделения водорода -532 мВ).
Таблица 7.8. Степень анодного и катодного ограничения коррозии стали в бетоне
|
Бетон |
|
Условия испытания |
Характер ограничения
С добавкой СаС12
1
В воде На воздухе*
|
Обычный На воздухе В воде Карбонизированный На воздухе |
|
0,256 0,329 0,551 0,167 0,963 0,512 0,22 0,78 |
|
0,744 0,671 0,449 0,833 0,037 0,488 0,780 0,22 |
В воде
Анодное
Катодно-аі Іодіюс
Анодное
Катодное
Като дно-анодное
Анодное
Катодное
'Первое значение для /'q2 =2,1-10 2, второе - для Pq2 =2.1-10 ' МПа.
Из табл. 7.8 и поляризационных кривых следует, что в атмосферных условиях, независимо от вида бетона, анодная поляризуемость выше, чем катодная. Следовательно, в зтих условиях катодный процесс существенно не ограничивает скорости коррозии. Этот важный вывод был подтвержден опытами. При относительной влажности воздуха 80% снимали кривую "время—ток", наложив на образец из бетона с В/Ц = 0,5 потенциал — 800 мВ (по НКЭ). Установившаяся через 1 —2 ч плотность диффузионного тока была в пределах 5—40 мкА/см2, чему соответствует возможная потеря металла 0,058—0,466 мм/год. Фактические потери (табл. 7.9) в бетонах с 4% СаС12 при той же относительной влажности значительно меньше. Следовательно, скорость поступления кислорода к поверхности арматуры в испытанных бетонах не ограничивает ее коррозии в воздухе с относительной влажностью до 80%.
|
Таблица 7.9. Коррозия арматуры в бетонах с 4% СаС12 при относительной влажности воздуха 80%
1:2,24:2,92 349 0,5 0,5 0,009 70 1.2,87:3,56 298 0,6 0,8 0,02 155 1:3,43:4,17 252 0,7 1,3 0,05 390 |
Разница в скорости коррозии стали в бетонах различной проницаемости (В/Ц) связана, по-видимому, с условиями миграции ионов железа в слое бетона, прилегающего к поверхности арматуры и соответствующим уплотнением слоя продуктов коррозии.
При катодной поляризации образцов, насыщенных водой, получены значения предельного диффузионного тока на три порядка меньше, чем в образцах в воздухе, соответственно меньше и расчетная скорость коррозии. Поскольку после 4 сут испытания ток продолжал падать, можно
полагать, чи) диффузионные токи могут оиіпчіїїьсн па 'І порядка подоц но коэффициентам диффузии в газал (1 • Ю-1 см1/с) ив жидкостях (1 - Ю-5 см2/с).
Данные опытов показывают, что коррозия арматуры в бетоне, паси щенном водой, сильно ограничивается кислородной деполяризацией катодных участков. Водородная деполяризация в этих условиях возможна лишь в карбонизированном бетоне с добавкой хлористого кальции, поскольку потенциал выделения водорода при рН = 12,5 находи їси ниже 735 мЬ по НВЭ.
Скорость коррозии стали во влажном бетоне можег Оыть зпачнтши. ной. В табл. 7.10 приведены обобщенные результаты испытаний во влажной атмосфере (7.3). В большинстве случаев коррозия развнваеіси неравномерно, образуя язвы глубиной до 1,5 мм за год.
Таблица 7.10. Скорость коррозии стали в бетоне во влажной атмосфере
|
Вид бетона |
|
Потеря массы стали r/fn2 . год) |
Максимальная глубина язв за год, мм
Обычный без добавок:
Плотной структуры О
Пористой структуры 13...210
|
О 0,48 1,63 |
С добавками хлоридов 10...660
Без добавок, карбонизированный 30
Попытка ограничить кислородную деполяризацию стали в бетоне с 5%-й добавкой СаС12 в атмосферных условиях путем тщательной изоляции поверхности образцов 8 слоями эмали ХСПЭ дала весьма скромные результаты (табл.7.11).
|
Таблица 7.11. Состояние стальных стержней в цементно - несчаном растворе с 5%-й добавкой СаСЬ
|
Степень коррозии арматуры в бетоне с 5%-й добавкой СаС12 находи лась в прямой зависимости от его проницаемости. Образцы вскрывали после четырех сроков (через 6, 12, 24 и 36 мес после начала испытания) хранения при относительной влажности воздуха 90%. Как обычно, при т.; ких испытаниях получили большой разброс результатов. Поэтому с целью повышения достоверности при сравнении подсчитали средневзвешенную скорость коррозии за все четыре срока. Толщина защитного слоя практически не оказала влияния на скорость коррозии арматуры (табл. 7.12).
|
Таблица 7.12. Средневзвешенная скорость коррозии арматуры в бетонах с 5%-й добавкой СаСЦ
|
|
* Бетон без СаСІ2 карбонизирован полностью. |
По-видимому, плотная структура бетона, не лимитируя катодный процесс кислородной деполяризации, ограничивает электродные проц ссы, влияя и на концентрационную поляризацию. Процесс коррозии замедлялся во времени, однако за периоде 6 до 36 мес коррозионные потери возросли в 1,5—3 раза.
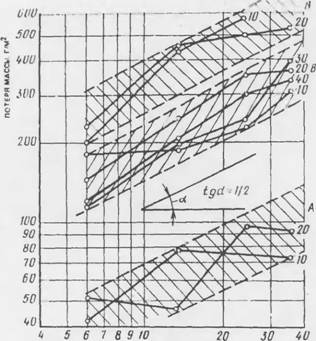
На рис. 7.19 зависимость коррозионных потерь от времени изображена в логарифмических координатах. Тангенс угла наклона линий, ограничивающих области для бетонов разной проницаемости, равняется 1/2, т. е. потери металла возрастают пропорционально квадратному корню из времени, а процесс затухает, как и многие другие гетерогенные процессы, контролируемые диффузией реагентов в плотном слое продуктов реакции (7.31).
Потери от коррозии стали в карбонизированном с В/Ц- 0,7 бетоне за 25 мес были почти на порядок ниже, чем в бетоне того же состава, но с 5% CaCU и примерно соответствовали потерям в бетоне с В/Ц = 0,5 и добавкой 5% СаС12. Характер поражения арматуры в бетоне без СаС12 более равномерный, с менее глубокими язвами. Эти различия можно объяснить, с одной стороны, повышением омического сопротивления бетона после карбонизации, а с другой — повышенной гигроскопичностью и проводимостью бетона с добавкой.
Термодинамические расчеты, выполненные В. И. Бабушкиным (7.6), показали, что в воздушно-влажном бетоне имеется достаточное для протекания коррозии количество кислорода.
В работе [7.11] исследовалось коррозионное поведение высокопрочной арматурной стали в виде проволоки В-И диаметром 3 мм и стержней класса Ат-V в балках соответственно из керамзитобетона и тяжелого бетона за время хранения на открытом воздухе в течение соответственно 7,5 и 9 лет. Бетоны готовились с добавками СаС12, нитрит-нитрата кальция (ННК) и нитрит-нитрат-хлорида кальция (ННХК). Результаты механических испытаний извлеченной из балок арматуры, % значений в сос-
|
ВРЕМЯ МЕС Рис. 7.19. Коррозионные потери стали в бетоне с добавкой 5% СаС12 и В/Ц = 0,5 (/1), 0,6 (Б), 0,7 (В). Толщина защитного слоя от 10 до 40 мм |
Тоянии поставки, приведенные в табл. 7.13, подтвердили опасность до бавки СаСІ2 для высокопрочной арматуры и безопасность нитрит-нитра та кальция.
|
Таблица 7.13. Остаточные прочности и удаления при разрыве арматуры из бетона с добавками
|
В табл. 7.14 приведены данные, показывающие опасность комплексной добавки, содержащей СаС12, для высокопрочной проволоки в керамзитобетоне.
Таблица 7.14. Изменение равномерного удлинения проволоки в бетоне с добавкой ННКХ
Добавка, % СаС12 :Ca(N02)2 Минимальное значение 6р, %
|
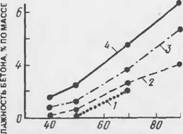
M ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ ВОЗДУХА % Рис. 7.20. Равновесная влажность бетона с добавкой СаСІ2 (% хлорид-ионов) 1-0; 2-2; 3-5; 4-І |
|
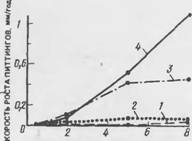
Рис. 7.21. Скорость потери массы металла при разном количестве хлоридов в бетоне. Относительная влажность воздуха, %: 1 - 40; 2 - 50; 3 - 70; 4-90 |
|
И СОДЕРЖАНИЕ ХЛОРИД-ИОНОВ В БЕТОНЕ. * |
Рис. 7.22. Скорость роста пиггиигов на поверхности арматуры при разном количестве хлоридов в бетоне. Относительная влажность воздуха, % 1 - 40; 2 - 50; 3 - 70; 4-90
Арматуры, связанное с действием атмосферных осадков, технологических источников увлажнения воздуха или выпадения конденсата в результате образования точки росы на поверхности конструкций (в основном ограждающих, главным образом плит покрытий при недостаточной теплоизоляции) .
Омическое ограничение для процесса коррозии стали в бетоне с хлоридами имеет меньшее значение вследствие, во-первых, их гигроскопичности, и, во-вторых, большей электропроводности жидкой фазы. Снижение влажности такого бетона может вызвать усиление локализации коррозии (питтингообразования).
Катодное ограничение коррозионного процесса стали в бетоне наиболее эффективно проявляется в конструкциях, постоянно погруженных в воду, вследствие резкого затруднения диффузии кислорода в ненере - мешиваемом электролите, заполняющем поры. Оно может, как показано, например в [7.2], играть более или менее существенную роль в конструкциях из особо малопроницаемого бетона.
В [7.16] показано, что простейшие конструкции ребристых плит покрытия животноводческих зданий при значительной коррозии ненапря- гаемой арматуры, сопровождающейся почти полным разрушением карбонизированного защитного слоя, сохраняют несущую способность в течение 8—10 лет. Однако их эксплуатация в таком состоянии представ
ляет опасность для животных и людей, а ремонтопригодность стремится к нулю. Поэтому, видимо, период развития коррозии арматуры можно учитывать только при анализе предаварийных ситуаций, подобных описанной, и допуская такое только в конструкциях с чисто экономической ответственностью. Очевидно, нельзя учитывать такие ситуации при проектировании конструкций. Предельным состоянием но долговечности необходимо считать начало коррозии, связанное с карбонизацией защитного слоя, как это предусмотрено методикой, изложенной в наших работах [7.5, 7.29, 7.20].
Безусловно, недопустимо развитие коррозии, особенно хлоридной, высокопрочной арматуры предварительно напряженных конструкций, которая отличается большой склонностью к хрупким коррозионным разрушениям, что обычно приводит к внезапному обрушению конструкций.







Оставить комментарий