24 Окт 12 ТЕОРИЯ ПРОЦЕССА КОРРОЗИИ СТАЛИ В БЕТОНЕ
Электрохимическая природа коррозии. Процесс коррозии металлов в подавляющем большинстве случаев имеет электрохимический меха низм, для действия которого необходимо присутствие влаги на поверхности металла.
На поверхности корродирующего металла образуются анодные и катодные участки. На анодных участках осуществляется растворение металла (анодное окисление), ионизация атомов, переходящих в ви «с гид- ратированпых анионов в раствор. Образующиеся свободные электроны, оставаясь и кристаллической решетке металла, перемещаются к катодным участкам его поверхности, где гни ассимилируются либо атомами растворенного кислорода, либо ионами водорода (катодное восстановление) . Электрическая цепь замыкается через раствор электролита, в котором идет перемещение гидратированных ионов.
Продукты коррозии являются результатом вторичных процессов взаимодействия гидратированных ионов с кислородом. Если они хорошо растворимы, то могут переноситься от места их образования. Если же труднорастворимы, какими являются, как правило, продукты коррозии стали, то откладываются на ее поверхности, образуя более или менее четко выраженный растущий слой ржавчины, которая состоит из оксидов и гидроксидов железа.
Следовательно, для протекания процесса электрохимической коррозии необходимы следующие условия:
Наличие активных участков поверхности металла, способных к анодному растворению — переходу атомов в растворимые ионы по реакции:
Fe2+ +2е ■*- Fe, (7.1)
Наличие веществ, необходимых для протекания катодной реакции, например с восстановлением кислорода:
02 + 4е + 2 Н20 -*■ 40Н~,
Наличие электролита, в котором может осуществляться движение ионов между анодом и катодом.
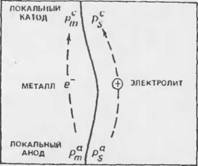
Электродные потенциалы. Работающая коррозионная пара характеризуется разностью электрических потенциалов (рис. 7.1).
Если Рт и Ps электрические потенциалы в смежных точках поверхности металла и электролита, разделяемых электрическим двойным слоем из множества заряженных частиц и ориентированных диполей воды, и если знаками "а" и "с" обозначить их принадлежность соответственно аноду и катоду, то
|
|
Тогда (P^-ty < (P*-F$).
Разность (Рт - Ps) представляет собой падение потенциала в двойном электрическом слое и именуется потенциалом электрода Е. Потенциал локального анода всегда ниже, чем потенциал катода в коррозионной паре. Разность потенциалов (Ес — Еа) может быть очень малой, если анод и катод расположены близко, как это свойственно микропаре, и проводимость электролита высока, но может достигать нескольких сотен милливольт при высоком сопротивлении среды.
Потенциалы электродов выражаются обычно относительно обратимых электродов сравнения, имеющих постоянный потенциал (стандартный водородный электрод Е = 0,00 V, медно-сульфатный электрод Е - = +0,32 V относительно водородного, насыщенный каломельный электрод Е = +0,25 V по водородной шкале).
Коррозия в термодинамическом аспекте. Электрохимическая реакция с участием z-электродов
ПдА + пъВ + ze = псС + п^ D При постоянной температуре и давлении имеет равновесный потенциал:
|
|
|
[А]па ■ [В]пЬ \с]пс. [D\"(l |
Где R - гаэовая постоянная; Т - абсолютная температура- F — постоянная Фарадея; Е° - стандартный электродный потенциал реакции; [Л] и т. д. - активность ионов и па и т. д. - число их молей.
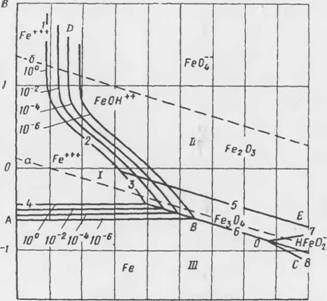
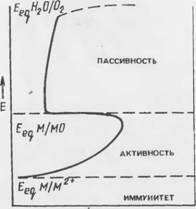
Эта реакция идет самопроизвольно слева направо, если Е < Ещ. Следовательно, если известно Е° электрохимической реакции, можно предсказать термодинамическую возможность ее при известных концентрациях реагентов и продуктов реакции. Результатами таких расчетов являются диаграммы потенциал — рН (диаграммы Пурбз) (рис. 7.2).
|
(7.2) |
Здесь концентрация ионов, кроме Н+ + ОН .принята (миллимоль) и твердые фазы чистые.
|
|
Рис. 7.1. llo генцианы и токи в корро- шоппои ячейке
|
-2 0 2 4 6 8 10 12 /« рН Рис. 7.2. Диаграмма ІІурбз для Fe-H20 при 25°С |
Области стабильности растворимых ионов соответствуют коррозии,- поскольку анодные реакции, идущие с образованием Fe2+ или FeO 0Н~ термодинамически возможны:
Fe = Fe2+ + 2е\
Fe + ЗОН - = FeO ОН - + Н20 + 2е.
Области стабильности оксидов Fe304 и Ре20з соответствуют состоянию пассивности, которое возникает в результате анодных реакций с образованием защитных оксидных пленок на поверхности металла:
3Fe + 4H20 = Fe304 +8H+ + 8Ј>;
2 Fc + 3H20 = Fe203 + 6H+ + Be.
Область стабильности железа, его иммунности к коррозии соответствует термодинамической невозможности анодного растворения металла.
Нельзя переоценивать значения диаграмм равновесия, показывающих лишь термодинамическую возможность тех или иных реакций, но ничего не говорящих об их кинетике, а также не учитывающих изменений состава электролита вблизи корродирующей поверхности, существования градиентов концентраций.
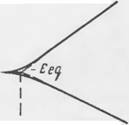
Поляризация электрохимических реакций. Согласно изложенному выше равновесие единичной электродной реакции существует, когда электродный потенциал Е принимает значение ЕСц. При этом скорости обратимых анодного и катодного процессов, выражаемые плотностями токов ід и іс, соответственно равны и противоположны:
Где і - плотность тока обмена реакции.
При Е > Еец преимущество имеет анодный процесс {ia > | ic\ ), а при Е < Eeq преобладает катодный (ia < | ic | ).
В том или другом случае говорят, что электрод поляризуется, т. е. его потенциал смещается на величину перенапряжения:
%=E-Eeq>Vc = Ecq~E
Зависимости между перенапряжением и плотностью тока для конкретных электродных процессов, играющих роль в коррозионных реакциях, могут быть определены экспериментально путем контроля потенциала исследуемого металла (рабочего электрода) с помощью потенцио - стата.
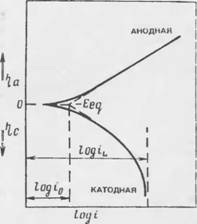
Результирующие графики (г/ — (/) (или log і) называют поляризационными кривыми. Формы, которые принимают эти зависимости, определяются природой стадии, контролирующей скорость обсуждавшихся электродных процессов (рис. 7.3).
На рис. 7.3 приведены поляризационные кривые электродных процессов, скорость которых ограничивается стадией, включающей термически активированный перенос заряда; для т? > 50 мВ зависомость между перенапряжением и плотностью тока известна как уравнение Тафеля:
Па = ъа log 0а//о); vc = Bc log (/с//0) ,
Где коэффициенты Тафеля bQ и Ьс - постоянные реакции при неизменной температуре.
На рис. 7.4 показаны поляризационные кривые электродных процессов, таких как 02 + 2Н20 + 4е ^ 40Н~, когда скорость катодной реакции ограничивается массопереносом реагентов при их диффузии к поверхности электрода (так называемая концентрационная поляризация) ; при больших значениях перенапряжения пс плотность катодного тока Ic приближается к предельному значению І/ , величина которого зависит от температуры, перемешивания раствора и пр. Зависимость имеет вид 140
|
Рис. 7.4. Поляризационные криль электродного процесса, ограничении! о диффузией кислорода к катоду |

|
АНОДНАЯ |
|
КАТОДНАЯ |
______ і_____________
Lo9i
Рис. 7.3. Поляризационные кривые электронною npoiiecca, скорость которого ограничивается термически активированным переносом заряда
Т}с = const, log (/ - IJiL).
В общем форма поляризационной кривой единичного электродного процесса должна отражать тенденцию возрастания скорости реакции І С возрастанием перенапряжения т\.
Если, однако, электрод способен поддерживать различные реакции при разных электродных потенциалах, то формы поляризационных кривых могут быть аномальными.
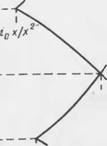
Например, металл М способен растворяться анодно, образуя ионы М2+ при Е > ЕС[/, М/А12+ (М - М2+ + 2е), ьо может образовывать поверхностную оксидную пленку (МО) при Е> Etq, М/МО, (М + Н20 = МО + 2Н+ і + 2е). Результирующая анодная поляризационная кривая представлена на рис. 7.5.
При значении Е < Eeq, M/M^+ анодное растворение термодинамически невозможно и металл иммунен к растворению, смещение к значениям > Eeq, М/М2+ ведет к активному растворению со скоростью, которая первоначально растет с увеличением перенапряжения. При некотором по тенциале, более положительном, чем Еед, М/МО, однако, активное растворение практически прекращается вследствие образования поверхностной оксидной пленки, делающей металл пассивным и пропускающей лишь малый 'остаточный ток, который совсем незначительно увеличивается с дальнейшей поляризацией. Если оксидная пленка і. меет электронную проводимость, то на электроде может происходить анодное вое становление кислорода из воды (2Н20 = 02 + 4Н + 4е) при потенциале более положительном, чем ECq,..., HjO/C^ с соответствующим резким возрастанием плотности анодного тока.
Дополнительные эффекты могут наблюдаться в определенных системах, например, многие пассивирующие. я металлы и сплавы могут стра-
|
|
|
ВЫДЕПЕНИЕ О. |
|
Рис. 7.5. Анодиая поляризационная кривая, иллюстрирующая переход от активного растворения к пассивации |
|
TЈ2—^— |
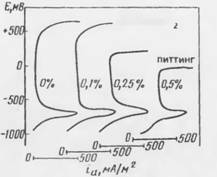
Рис. 7.6. Анодные поляризационные кривые для стали в насыщенном растворе гидроксида кальция с различным содержанием двуводного хлорида кальция
Дать от явления локального разрушения защитной оксидной пленки, известного как питтинг, когда электролит содержит агрессивные ионы (такие, как С1— или Вг—) и электродный потенциал достигает некоторого критического значения, которое зависит от концентрации галоида и рН раствора (рис. 7.6).
Когда электродный потенциал становится более положительным, чем потенциал питтингообразования, средняя плотность анодного тока возрастает из-за интенсивного локального растворения металла в отдельных точках при пассивности окружающей их поверхности.
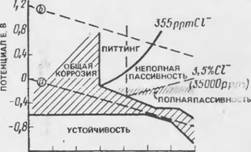
Поляризационные кривые для отдельных металлов, изучаемых в быстроперемешиваемых растворах точно известного сосіава нри 25°С, удобно обобщать в виде Е-рН-диаграмм, подобных приведенной на рис. 7.7. Области иммунности, активности и пассивности вполне согласуются с областями термодинамической стабильности железа, растворимых ионов железа и оксидов железа, как видно на рис. 7.2. Дополнительно из области пассивности выделена часть, где возможен питтинг.
Диаграммы, подобные приведенной на рис. 7.7, часто полезны для справки о коррозионном поведении металлов в различных средах, если не забывать, что они несут информацию, отвечающую условиям минимальной концентрационной поляризации. Поэтому было бы ошибочным их прямое приложение к практическим коррозионным проблемам, имея в виду возможные эффекты, которые могут возникнуть в условиях ограниченного массопереноса.
Коррозионные потенциалы и скорости коррозии. Обсуждению поляризационных кривых способствует рассмотрение поведения электродов, функционирующих как суммарные аноды или катоды ячеек, к которым напряжение прикладывается от внешнего источника тока (потенцио - стат). Это упрощенная модель, так как на поверхности свободно корродирующего металла раздельные анодный и катодный процессы происхо-
|
|
|
Рис. 7.7. Диаграмма потенциал - pll, иллюстрирующая корроэиои - иос поведение железа в растворах с хлоридами |
|
Р |
|
2 4 6 в 10 12 /4 РН |
|
► |
|
С |
|
|
|
Есогг |
|
1С0ГГ |
|
Ееи"/"* |
|
|
|
Плотность ТОКА |
|
І0Фг* |
Дят одновременно с одинаковой скоростью на одной и той же поверхности смешанного электрода.
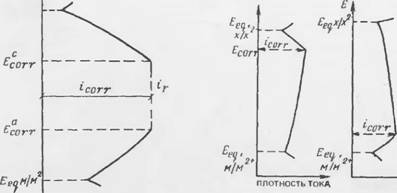
Простейшей формой коррозионного процесса является такой, в котором одна поляризуемая анодная реакция (М — Ze = Л/г+) и - одна катодная {X + Ze = X2-) сопрягаются, чтобы образовать множество микроячеек на поверхности металла в электролите высокой проводимости. Па рис. 7.8 представлены поляризационные кривые для самостоятельных анодной и катодной реакций, пересекающиеся в точке Р, где средние анодная и катодная плотности тока равны и представляют скорость коррозии, выраженную средней плотностью коррозионного тока (/согг> Электродный потенциал нары в этой точке называют коррозионным потенциалом Есоп.
Как отмечалось выше, всегда существует разница между электродными потенциалами анодных и катодных участков на поверхности металла. Разница незначительна, когда коррозия носит характер действия микро пар, и становится существенным омическим падением Іг в условиях, где образуются коррозионные макропары, когда анодные и катодные участки поверхности разделены средой с высоким электролитическим сопр* тивлением (рис. 7.9). Средняя скорость коррозии, выражаемая чере 'согг' теперь снижается и коррозионный потенциал изменяется с расположением между Egorr и е£огг, места локальных анодов соответствую областям низких коррозионных потенциалов (Е£огг). Практически это может быть использовано для обнаружения мест коррозионного поражения (анодных участков) по замерам потенциалов в конструкциях, где возникают макропары.
В отсутствие значительного омического падения средняя скорость коррозии (icorr) зависит от значения разницы между обратимыми потенциалами анодной и катодной реакций и среднего наклона анодной и катодной поляризационных кривых. Если анодная реакция круто пол?
Рис. 7.9. Диаграмма Эванса для корро - стрирующие процесс коррозии зионной ячейки с омическим падением а - с анодным контролем; б - то же.
С катодным
Ризуется (например, благодаря наличию пассивной пленки), то icorr мал и Есогг принимает значение, близкое обратному потенциалу катодной реакции (рис. 7.10). Наоборот, если катодная реакция круто поляризуется (например, из-за ограничения поступления кислорода), возникает ситуация, отраженная на рис. 7.11, когда icon снова мал, но коррозионный потенциал близок обратимому потенциалу анодной реакции.
Из этих рассуждений ясно, что коррозионный потенциал не является ни свойством корродирующей системы, ни надежным указателем скорости коррозии. Если, например, наблюдается смещение коррозионного потенциала с течением времени в отрицательном направлении, то это означает либо облегчение анодной реакции и ускорение коррозии, либо подавление катодной реакции и замедление коррозии. В системах, для которых возможен выбор между этими альтернативами, конечно, есть основание ожидать корреляцию между коррозионным потенциалом и скоростью коррозии и получить простейший метод коррозионного мониторинга.
Коррозионные состояния стали в бетоне. Пассивное состояние. Плотный бетон, не карбонизированный действием кислых газов атмосферы, имеет высокую щелочность (рН МЗ) поровой влаги, создаваемую присутствием NaOH, КОН и Са(ОН)2, образующихся при гидратации зерен клинкера. Поровая влага обычно содержит достаточно растворенного кислорода.
В такой среде, как следует из диаграммы Пурбэ (см. рис. 7.2), стальная арматура находится в состоянии пассивности, и скорость коррозии ее пренебрежимо мала вследствие защитного действия оксидной пленки.
|
Потенциала |
|
Е , Еру*/х* |
|
At E |
|
ПЛОТНОСТЬ ТОКА Плотность ТОКА Рис. 7.10. Диаграммы Эванса, иллю |
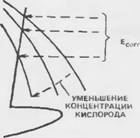
Коррозионный потенциал стали в таких условиях меняется в широких пределах от +200 до —200 мВ по насыщенному каломельному электроду в зависимости от доступа катодного деполяризатора — кислорода, как
|
'0,5 |
Рис. 7.11. Диаграмма Эиаиса, иллюстрирующая іілшіііш' концом грации кислорода на коррозионный потенциал пассивной стали в бетоне
|
|
|
-0,5 |
|
ПЛОТНОСТЬ ТОКА |
|
О |
|
ЗНАЧЕНИЯ |
|
-1 |
Показано на рис. 7.11. Для конструкций на воздухе, однако, уровень растворенного кислорода обычно достаточен, чтобы поддерживать коррозионный потенциал пассивной стали в пределах от +100 до —200 мВ по насыщенному каломельному электроду.
Стабильность пассивного состояния стали зависит от качества бетона и толщины защитного слоя. Они определяют способность системы сопротивляться агрессивным веществам, которые постепенно изменяют состав поровой влаги в направлении опасности для пассивности стали и интенсивной коррозии.
Состояние питтинговой коррозии. Как было показано выше пассивность стали в щелочной среде может быть нарушена хлорид-ионами. Они могут попадать в бетон разными путями и, если их содержание превышает определенный уровень, вызывать питтинговую коррозию стали. Такое коррозионное состояние характеризуется образованием гальвани ческих пар с большой пассивной поверхностью стали, действующей как катод, и малыми анодными язвами, внутри которых поддерживается высокая концентрация хлорида и пониженное значение рН. Для развитии питтинга необходима концентрация кислорода, достаточная, чтобы ано ды были заполяризованы до потенциала, более положительного, чем потенциал пигтингообразования (пробоя), характерного для конкретной среды (см. рис. 7.7).
Средний коррозионный потенциал стальной арматуры, подвергаю щейся питтингу, изменяется в пределах от соответствующего ее пассиь ному состоянию до потенциала циттинговых анодов, обычно от —200 до —500 мВ по насыщенному каломельному электроду. Анодные участки с наиболее отрицательным потенциалом обычно бывают окружены поверхностями с высокими градиентами потенциала.
Состояние общей коррозии. Для поддержания пассивности стали в небуферном щелочном электролите значение рН должно быть не ниже 11,5. (Отчасти более низкий порог рН, около 9, может быть допущен в оуфер - ных растворах благодаря понижающему эффекту, связанному с гидролизом продуктов анодной реакции.)
В бетоне обитая потеря пассивности может, таким образом, возникать, если рН поропой влаги у поверхности арматуры значительно понизится против исходного высокого значения. Это может быть результатом
нейтрализации под действием поглощаемых бетоном кислых газов (С02 и др.) из воздуха и давать начало общей коррозии стали. Общая корро зия в большей или меньшей степени может также наблюдаться в бетоне, сильно загрязненном хлоридами, когда полностью разрушается пассивная пленка.
Коррозионный потенциал арматуры, подвергающейся общей коррозии, обычно находится в пределах от —450 до —600 мВ относительно насыщенного каломельного электрода, т. е. близко к потенциалу незащищенной стали в нейтральной воде. Градиенты потенциала в конструкции в таких условиях не столь велики, как при питтинговой коррозии.
Состояние активной, низкопотенциальной коррозии. В средах, где поступление кислорода крайне затруднено, как, например, при полностью погружаемых или погребенных конструкциях, ограниченная катодная плотность гока може г со временем оказаться псдосіаючной, ч і обы поддерживать пассивную пленку на поверхности стали (рис. 7.12).
При таких обстоятельствах металл ведег себя активно в высокощелочной среде, подвергаясь равномерному растворению с образованием FeOOH - ионов, как следует из диаграммы Пурбэ (см. рис. 7.2). Коррозионный потенциал падает до значений от —850 до —1000 мВ по НКЭ, скорость же растворения металла исключительно низка благодаря ограниченному доступу катодного деполяризатора — кислорода.
Временная зависимость коррозионных состояний. Можно ожидав изменения коррозионного состояния стали в бетоне с течением времени. Можно предложить удобную модель изменения коррозионного поведения во времени в виде двух этапов.
Инкубационный период. В течение этого этапа находящийся в бетоне металл остается пассивным, поскольку предел этому состоянию определяется временем взаимодействия бетона со средой.
Коррозионный период. Начинается с момента депассивации и включает развитие коррозии с заметной скоростью, пока не будет достигнуто предельное состояние, когда конструкция теряет несущую способность, эксплуатационные свойства или внешний вид.
Долговечность железобетонной конструкции, таким образом, схематически может быть представлена совокупность этих периодов (рис. 7.13).
Изложенное позволяет сделать следующие выводы: сталь в бетоне может находиться в различных коррозионных состояниях как в зависимости от его первоначального состава, так и изменения его (главным образом жидкой фазы) под действием агрессивных компонентов среды;
Следует стремиться к тому, чтобы бетон но своему составу обеспечивал пассивное состояние стальной арматуры, начиная с момента изготовления конструкции, и поддерживал его в течение расчетного срока службы, для чего, очевидно, он должен быть малопроницаем для среды, иметь достаточную толщину и реакционную емкость;
Продолжительность периода взаимодействия бетона в пределах защитного слоя со средой, результатом чего является нарушение пассивного состояния стальной арматуры, по существу определяет долговечность железобетонной конструкции, так как может рассматриваться как одно из предельных состояний ее в агрессивной среде;
Относительно продолжительности развития коррозии арматуры после потери ею пассивности пока можно высказать только самые общие сооб-
Рис. 7.12. Диаграмма Эванса, иллюстрирующая состои - иие активной низкопотеициальиой коррозии стали в бетоне
ПРЕДЕЛЬНОЕ СОСТОЯНИЕ
ИНКУБАЦИОННЫЙ ПГРИОД
(ІШІШОСІЇ I OK
HJMtHLHML I
СВОЙСТВ І]. ДЕ ПАССИВАЦИЯ
11 РАЗВИТИЕ'
КОРРОЗИИ
ДОЛГОВЕЧНОСТЬ
Рис. 7.13. Схематическое представление о составляющих долговечности
Ражения, а именно, что она может быть весьма большой в дьух случаях: когда скорость коррозии ограничивается большим омическим сопротивлением сухого бетона и когда скорость коррозии ограничивается малой проницаемостью бетона для кислорода, т. е. он полностью и постоянно насыщен водой. Для прочих влажностных состояний проводить какие - либо расчеты допустимой длительности коррозии арматуры преждевременно, учитывая как механическое разрушение бетона в защитном слое растущим на поверхности арматуры слоем ржавчины, так и потерю плас тичности (охрупчивание) арматуры вплоть до коррозионного растрескивания ее высокопрочных разновидностей.





Оставить комментарий