24 Окт 12 КОРРОЗИЯ II ВИДА
Коррозия II вида отличается от коррозии первого вида тем, что повреждение бетона определяется не только растворением компонентов цементного камня, но и их химическим взаимодействием с агрессивными компонентами, содержащимися в воде с образованием растворимых продуктов коррозии или с выделением трудно рас іворимьіх соединений в виде рыхлых новообразований, не обладающих прочностными свойствами. Если при коррозии I вида ее интенсивность ограничивается низкой растворимостью основного, выщелачиваемого компонента цементного камня — гидроксида кальция, — то при коррозии II вида степень коррозионного повреждения определяется реакционной емкостью раствора и свойствами продуктов коррозии. В зависимости от второго фактора коррозионный процесс может идти с постепенным усилением по мере разрушения цементного камня, а может и затухать, если продукты коррозии нерасторимы и создают труднопроницаемую оболочку на внешнем поверхности бетона или на внутренней нонсрхносш порового проегранеіва. Во всех случаях наложение химического процесса на пронеси/ растворения гидроксида кальция значительно усиливает коррозионный процесс.
Щелочная природа цементного камня обусловливает перечень соединений, агрессивный по II циду коррозии. Наибольшей агрессивностью обладают кислоты, затем кислые соли и некоторые соединения, способные реагировать с компонентами структуры цементного камня.
Интенсивные исследования кинетики коррозионных процессов при контакте кислот различного вида с цементным камнем, выполненные под руководством В. М. Москвина, позволили подойти к количественной оценке интенсивности коррозионных процессов [5.30]. Изучение кислотной коррозии в условиях полного погружения проводилось и ранее [5.77].
В работах [5.29,5.41] было показано, что довольно быстро при незначительном углублении фронта взаимодействия кислоты и цементного камня коррозионный процесс начинает идти с диффузионным' ограничением в условиях нарастающего слоя продуктов реакции, затрудняющих доступ кнелоты к компонентам структуры цементного камня. Исследования продуктов реакции [5.17, 5.18] показали, что их состав изменяется в зависимости от вида кислоты и главным образом зависит от растворимости кальциевой соли данной кислоты, поскольку основной процесс — это нейтрализация кислоты при реакции с гидроксидом кальция.
Углекислотная коррозия. Наиболее распространенным процессом коррозии II вида в природных условиях является взаимодействие углекислоты воздуха с гидроксидом кальция цементного камня (процесс карбонизации бетона).
Этот процесс в значительной степени определяет сроки сохранения защитных свойсів бетона по отношению к арматуре и подробно рассмотрен в гл. 8. Процесс карбонизации приводит к двум результатам — уплотнению и повышению стойкости бетона при переходе гидроксида кальция в карбонат кальция и отрицательному влиянию карбонизации чащпіпого слоя бенша у арматуры на стойкость железобетонной конструкции вследствие дснасошацин арматуры и возможностей коррозии. Агрессивное действие углекислоты на бетон возможно и при ее повышенном содержании в воде [5.81]. Угольная кислота в воде диссоциирует в две ступени:
Н2со3=^ H+ + HCOJ
Следовательно, в воде устанавливается подвижное равновесие между Н2С03 ^ 2Н+ + СО|".
Чем больше в воде содержится НСО3, тем больше в равновесии с этим анионом должна быть и С02. Если же количество С02 превышает равновесие, то оно способно реагировать с цементным камнем с образованием новых количеств СаС03, т. е. такая углекислота будет агрессивной.
Константы диссоциации для зтих реакций равны:
[Н+] [НСОЛ 7
/С = 1----------------- IL = 3j04 • 10"7;
[Н2С03] 83
[H+] [CO.2-] ..
К = —2—L = 4}0і • Ю-11.
[ИСО"]
Из этих уравнений следует, что соотношение между отдельными формами зависит от концентрации водородных ионов рН (табл. 5.3).
|
Таблица 5.3. Относительное содержание различных ионов в растворах углекислоты в зависимости от рН [5.1]
Н2С03 99,7 97 76,7 24,99 3,22 0,32 0,02 HCOJ 0,3 3 23,3 74,98 96,7 95,84 71,43 20 СО^- - 0,03 0,08 3,84 28,55 80 |
Для устойчивого состояния НСО3" в присутствии ионов необходимо некоторое количество С02.
Углубленное рассмотрение процесса углекислой коррозии приведено в [5.19, 5.81] и не входит в нашу задачу.
При контакте с поверхностью бетона воды, содержащей углекислоту, будет нейтрализоваться гидроксид кальция с образованием карбоната кальция, а затем новые количества углекислоты будет растворять и вновь образовавшийся карбонат кальция, и существовавший в поверхностном слое — как результат карбонизации цементного камня углекислотой воздуха. Процесс будет идти с поверхности в глубь бетона и его интенсивность будет определяться концентрацией углекислоты в воде-среде. Опасность углекислотной коррозии будет существенно различаться в зависимости от условий контакта воды и бетона. При свободном омывании водой поверхности достаточно массивных сооружений, когда процесс коррозии происходит при диффузионном контроле потока гидроксида кальция из глубины к поверхности бетона, содержание в воде углекислоты будет усиливать растворяющее действие воды пропорционально содержанию углекислоты. При этом, так как С02 выводит в раствор Са2+-ион в виде Са(НС03)2 на каждый моль будет удаляться 1/2 моля Са2+, или в расчете на соотношение но массе — на каждые 100 мг С02 в растворе будет удаляться 64 мг СаО.
Если учесть среднюю растворимость в воде Са(ОН)2 — 1200 мг/л (в расчете на СаО), то следует признать, что в этих условиях присутствие С02 в воде незначительно (примерно на 5%) будет увеличивать агрессивность воды. Другое дело в случаях, когда карбонатная пленка на поверхности бетона защищает его от коррозионного воздействия других веществ, агрессивных по отношению к камню, например в морской воде. В этом случае практически нерастворимый в воде СаС03, составляющий пленку, растворяется в воде, содержащей углекислоту, и защитное действие карбонатной пленки уничтожается. При фильтрации воды под напором через тонкостенные железобетонные конструкции взаимодействие С02 с Са(ОН)2 будет в первоначальный момент уплотнять бетон, но затем коррозионное действие воды, содержащей С02, будет усиливаться за счет более интенсивного разрушения цементного камня в результате не юлько расширения гидроксида кальция, но и обменных реакций между минералами цементного камня и углекислотой.
При фнлмрлцнн поды, содержащей углекислоты, через Самом но составу фильтраіа можно судить о характере процесса, іісли в фильтрате содержится Са(ОН)2, это значит, что углекислота задерживается в бетоне в виде СаС03, что должно его уплотнять. Но если в фильтрате обнаруживается Са (НС03) 2, можно ожидать усиления фильтрации за счет растворения как карбоната кальция, так и гидроксида кальция. Б этом случае появляется опасность коррозионного воздействия вод, содержащих углекислоту. Схема действия С02 на бетон при фильтрации (рис. 5.6) представлена по В. М. Москвину [5.28].
В лабораторных условиях, как правило, исследования проводили при достаточно высоких концентрациях агрессивного раствора, например- 300 мг/л [5.28]. Испытания ііа образцах малого размера с большой удельной поверхностью приводили к результатам, которые в значительной степени отражали выщелачивающее действие воды, усиливаемое растворением защитных пленок карбоната кальция. Эти результаты могут быть использованы для оценки сравнительной стойкости бетонов на различных цементах, однако, с обязательным учетом плотности — проницаемости цементного камня, которая зависит и от водопотребнос - ти цемента. Так, [5.19] было показано, что в растворах углекислоты пуццолановые портландцементы не имеют особых преимуществ перед портландцементом. Диффузия гидроксида кальция их цементного камня пуццоланового портландцемента идет медленнее, чем из цементного камня портландцемента вследствие меньшего содержания Са(ОН)2. Снижение прочности, аналогичное по величине прочности портландцементу, достигается при меньшем количестве удаленного СаО. Однако есть и другие данные [5.100]. При длительных испытаниях было показано, что глубина повреждения мало отличается для растворов на различных цементах. Образцы размером 4x4x16 см, состава 1:2 (цементлтесок) при В/Ц = 0,45, твердевшие 28 сут в нормальных условиях, были погружены в воде с жесткостью 1...1,5°Н, содержавшую 13—15 мг/л агрессивной
Со2.
После 15 лет определили глубину повреждения в мм [5.100]. Получены следующие данные:
|
Вид цемента |
По ртландцемент |
Шлакопортландцемент |
Пуццоланизи - рованные цементы с золой - уносом |
Глиноземистый цемент |
|
|
Обычный |
Белито - вый |
||||
|
Глубина повреждения, мм |
12 |
10 |
8-15 |
8-70 |
2 |
Эти данные должны быть учтены при разработке норм агрессивности для природных вод.
Проведено значительное число исследований по оценке степени агрессивности воздействия углекислоты на бетон.
Интенсивное разрушение бетона отмечается на сооружениях, в которых хранится или перемещается вода, насыщенная углекислотой (нарзанные источники). В то же время описанная выше схема взаимодейст-
|
|
Вия бикарбоната с гидроксидом кальция, приводящая к уплотнению бетона, была установлена на классическом примере самоэалечивания бетона Баку-Шолларского водовода [5.8]. В этом случае трубы были выполнены из монолитного недостаточно плотного бетона. При пуске водовода и частичном заполнении пресной водой началась коррозия бетона эа счет проникания в толщу бетона наружных минерализованных вод на участках, где трасса проходила по грунтам, оводненным минерализованными водами.
После пуска водовода при полностью заполненном внутреннем сечении и напоре воды, имевшей жесткость 13,7°Н началось постепенное уплотнение бетона, а в дальнейшем полное уплотнение бетона за счет кольматации пор отложениями карбоната кальция.
В нормах агрессивности воды по отношению к бетону в ЧССР были весьма жесткие требования — вода считалась агрессивной при содержании С02. более 10 мг/л. В стандарте СЭВ эта норма увеличена до
20 мг/л. В то же время есть данные о возможности увеличить минимальное содержание агрессивной углекислоты, при котором вода может считаться агрессивной, до 100 мг/л. Степень агрессивности воды будет зависеть от условий контакта воды и бетона сооружения. В нашей практике не отмечалось агрессивного действия подземных вод с содержанием агрессивной углекислоты до 200 мг/л, например на бетон железобетонных свай. Это можно объяснить быстрым образованием поверхностной защитной корки в плотном грунте в поверхностном слое бетона, состоящей из карбоната кальция и продуктов коррозии, остающихся на поверхности бетона. Повторное растворение карбонатной пленки требует интенсивной смены воды, содержащей агрессивную углекислоту.
Действие минеральных кислот. Интенсивность коррозионного процесса определяется наименьшей скоростью процессов: внешней диффузией (скоростью подвода агрессивного раствора к поверхности сооружения), внутренней диффузией ионов в порах цементного камня и химической реакцией.
При взаимодействии агрессивных сред с цементным камнем бетона в поверхностном слое образуются продукты коррозии. Интенсивность коррозии зависит от плотности — проницаемости этого слоя. Состав и свойства образующихся продуктов коррозии зависят от вида и концентрации кислоты.
Вопрос о степени опасности повреждения бетона минеральными кислотами, применение которых распространено в различных отраслях промышленности, исследовался экспериментально и теоретически. В і а - ботах Ґ. В. Любарской были получены количественные характеристики
Эффективных коэффициентов диффузии кислот и предложено разделять кислоты на три группы по растворимости их кальциевых солей [5.24].
К I группе относятся кислоты, в результате действия которых на цементный камень бетона образуется слой продуктов коррозии, состоящей из гелей кремнекислоты, гидроксида железа, гидроксида алюминия и незначительного количества кристаллических включений — солей кальция. Это соляная, азотная, хлористоводородная и другие сильные минеральные кислоты.
Ко [[ группе относятся кислоты с растворимостью кальциевых солей менее I г/л, которые при небольших концентрациях образуют слой продуктов коррозии, состоящей из тех же продуктов коррозии, что и при действии кислот I группы, а при высоких концентрациях — слой, состоящий из тех же солей (кремнекислоты, Fe(ОН)3, А1 (ОН) з) со значительным содержанием солей кальция в твердой фазе, что возможно при превышении концентрации аниона кислоты над растворимостью ее кальциевой соли. Присутствие солей кальция повышает плотность слоя продуктов коррозии и снижает скорость коррозионного процесса. К этой группе относятся фосфорная, серная, сернистая и другие кислоты.
К III группе относятся кислоты, растворимость кальциевых солей которых менее 0,002 г/л. Кислоты, образующие при всех значениях концентраций слой продуктов коррозии, состоящий из гелей кремнекислоты и гидроксидов железа и алюминия, уплотненных нерастворимыми солями кальция. К этой группе относятся щавелевая, фтористоводородная и кремнефтористоводородная кислоты.
Образовавшиеся на поверхности бетона продукты коррозии затрудняют доступ агрессивной среды к внутренним, еще не поврежденным частям цементного камня и значительно снижают скорость коррозионного процесса (рис. 5.7). В начальный период времени, когда слой продуктов коррозии еще незначителен, интенсивность коррозии определяется скоростью химической реакции — процесс находится в кинетической области. По мере роста слоя продуктов коррозии на поверхности бетона процесс замедляется и при дальнейшем увеличении слоя продуктов коррозии ішісіісивность коррозии определяется только диффузией агрессии пых ионов через нрокорродированный слой к еще не поврежденному бе тону — процесс переходит в диффузионную область.
Для процессов коррозии, находящихся в диффузионной области, справедливо уравнение, полученное на основе описания кинетики гетерогенной реакции (уравнение Таманна^, которое может быть записано в данном случае в следующем виде:
Іде б - глубина коррозионного повреждении; - коэффициент, постоянный для данного состава бетона м3/кг'; D* - эффективный коэффициент диффузии агрессивного вещества через слой продуктов коррозии, см /ч; С() - концентрации агрессивного вещества, кг/м3, Э - химический эквивалент, представляющий собой соотношение масс оксида кальция и кислоты, вступающих во взаимодействие, определяемый но уравнению
Э = тМСа0/пМкксл,
Где тип— сгехиометрические коэффициенты уравнения реакции между кислотой и оксидом кальция, а Л/^аО и ^кисл ~~ молекулярные массы оксида кальция и кие - лоты; т - время воздействия агрессивной среды иа бетоне, ч.
Исходя из равенства потока агрессивного вещества и количества оксида кальция, пошедшего на его нейтрализацию, можно следующим расчетом подтвердить применимость уравнения (5.1) [5.18].
|
<F,CM US |
|
Рис. 5.7. Глубина разрушения образцов цементного каїуіия и цементного раствора при действии растворов НС1 1,2- дробленый цементный камень; 3-5 - цементный камень. Концентрация НСІ 1 - 0,5 н; 2.3 - 0,1 н; 4 - 0,01 н; 5 - 0,001 н [5.42] |
|
0,5 |
|
5 10 15 20 Л, сут |
Согласно уравнению химической реакции в случае действия на цементный камень, например раствора НС1, имеем
"Л, кисл
|
ТМ, |
|
СаО |
|
СаО |
|
-СаС12 + Н20. |
+ 2НСІ 42
Выделим в цементном камне кубический обьем с длиной ребра, равной единице (6 = I). По уравнению химической реакции для потока агрессивного вещества, прошедшего через этот объем, можно записать
|
ПМ, |
|
Кисл |
|
«1 |
(5.2)
ТМ.
СаО
При этом Qj — количество СаО, которое содержалось в единичном объеме цементного камня и вступило в химическое взаимодействие с агрессивной средой, может быть определено как Ц■ к, где Ц — расход цемента, кг/м3, к — содержание СаО в цементе, доли единицы.
|
(5.3) |
|
(5.4) |
Тогда количество агрессивного вещества q2, вошедшее во взаимодействие с <7 j, определится как
ПМи
Q 2=Цк
СаО
Согласно уравнению Фика для потока агрессивного вещества q2 с концентрацией С0 можно записать
~ D* Cq/6. Для 6 Ф 1
ЦкпМ
Кисл
|
(5.5) |
|
ТМ, |
СаО 6
Откуда
D*Cn mMr n
Dds =-------- 9------ £ао_ d7 (5 б)
^^кисл Интегрируя (5.6), получим
82 В*СптМГаП — = О СаО. т + с (5 7)
2 ^"^кисл
При г = 0 имеем 6=0, так как слой продуктов коррозии еще не образовался. Тогда постоянная интегрирования С равна нулю. Решая (5.7) относительно б и введя обозначения
|
-J- |
О _ СаО
ПМк„сп
Можно записать
2 Р*С0Эт
(5.8)
1 В
Учитывая, что Ц (— + — ) = 1, формула для определения глуби:^і Рц ЦРв
Коррозионного поражения цементного камня в кислых средах может быть представлена в следующем виде:
_ /2Я*С0Э(1/рц + Х-)т 8 ~ V црй . (5.9)
Глубина коррозионного повреждения бетона может быть определена с учетом того, что эффективный коэффициент диффузии агрессивною вещества через слой продуктов коррозии цементного камня в бетоне и собственно в цементном камне один и тот же. Экспериментальные данные по определению глубины разрушения бетона при действии IlCI подтвердили применимость уравнения Таммана (рис. 5.8). С учетом площади, занятой заполнителем и приходящейся на единицу поверхности S3, коэффициент диффузии в бетоне может быть вычислен по формуле
D* = D*(l-S3), (5.10)
Или, полагая, что пористость по площади равна пористости но объему, получим
D* = D* (1 — V ), (5.11)
В J
Где У3 объем заполнителей в единице объема бетона, определяемый по форм де
V,=Q3/P3. (5-1)
С учетом (5.11) и (5.12) из формулы (5.8) получим
6 = у~2Р*С0Э(1 -<73/Р3)г'
Цк
Выразив (1 -GJPj) через Ц (1/рц + В/Цръ), получим зависимость (5.9).
Введя коэффициент A g, получим уравнение (5.1).
Для цементного камня, раствора и бетона AQ рассчитывается по формуле
= у/2( '/'ц + */Ц'вУ. (5.14)
К
Кроме того, для раствора и бетона AQ можно рассчитать по формуле
А JWESS. (5.15)
Цк
В формулах (5.14), (5.15): Aq — коэффициент, постоянный для данного состава бетона, м3 /кг[3]12; Рц, ри, р3 - истинная плотность цемента, воды, заполнителей; - расход заполнителей, кг/м3.
Формулы могут быть использованы для ориентировочных расчетов глубины повреждения бетона при действии минеральных кислот. Значения величин, входящих в формулы, известны для конкретных составов бетона. Эффективный коэффициент диффузии должен быть определен экспериментально (см. гл. 11).
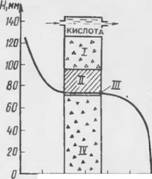
На рис. 5.9 приведены результаты исследований механизма кислотной коррозии по данным работы [5.18]. Исследование вели методом диффузии кислоты в колонке, заполненной дробленым цементным камнем. Эксперимент продолжался 700 сут. По высоте колонки произошло разделение на четко ограниченные зоны, различавшиеся по цвету продуктов коррозии.
|
МгСаО/смг |
|
|
|
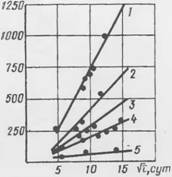
Рис. 5.8. Интенсивность коррозии в растворах кислот концентрацией 0,1 н і.41] 1 - НС1; 2 - НСООН; 3 - СН3СООН; 4 - H2SOt; 5 - HF |
Были проанализированы и исследованы РФА пробы продуктов из разных участков по высоте колонки (табл. 5.4). Результаты позволяют
выделить такие зоны, которые отличаются по величине pll в зоне и по степени разложения цементного камня. Метод испытаний позволил "растянуть" зоны. В действительности зона реакции значительно уже и должен отмечаться более резкий переход от одной зоны к другой.
|
№ Слоя |
|
2 4 Є в 10 12 рН |
|
Иис. 5.9. Изменение pll и поишіоние слота с различной степенью разрушения цементного камия по высоте колонки после действия 0,5 н раствора НС1 в течение 700 сут (см. табл. 5.4) [5.17; 5.18] |
Таблица 5.4. Химический состав слоев цементного камня после действия 0,5 н раствора НС1 [5.17]
|
Содержание, % |
|||||
|
Si02 |
А12о3 |
Ре203 |
СаО |
MgO |
S03 |
|
№ Пробы |
|
Фазовый состав |
2 Гель Si(OH)4, увеличе- 7,8 ние содержания
1'е(01П3 • Сз Л • 3CaSO.( •
• юн26
|
1,4 U |
|
3,5 15 |
|
7,5 10,5 |
|
80 60,2 |
|
2,7 4,3 |
C3F • СаС12 • ЮН20 CaS04-2II20 Остатки зерен клинкера
|
111 6 |
32,5 |
8,9 |
7,6 |
41,3 |
2,7 |
5,3 |
C3A-3CaS04 31Н20 С3Л - СаСІ2- ЮН20 Зерна клинкера |
|
IV 7 |
25,9 |
5,9 |
4,8 |
56 |
2Д |
4 |
Соединения гидратиро- |
|
8 |
22,7 |
5,3 |
4,6 |
59,7 |
1,7 |
2,8 |
Ванного портландце |
|
13 |
22,5 |
5 |
4.6 |
63,4 |
1,7 |
2,6 |
Мента |
|
14* |
21,3 |
4,6 |
4,3 |
66,6 |
1,6 |
2,3 |
Зерна клинкера |
•Исходный цементный камень.






Оставить комментарий